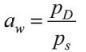Cele oraz kontrola renowacji antypleśniowej w zawilgoconych pomieszczeniach
Objectives and control of anti-mold renovation in damp spaces

FOT. Przykład ekstremalnego porażenia biologicznego przegród wewnętrznych budynku; fot.: B. Monczyński
Grzyby strzępkowe, nazywane również grzybami mikroskopowymi lub pleśniowymi, a potocznie pleśnią, stanowią dużą i zróżnicowaną morfologicznie grupę drobnoustrojów należących do królestwa Fungi [1]. Pleśnie występują powszechnie w środowisku naturalnym, wykazując przy tym niezwykłą zdolność przystosowania się do warunków otoczenia, co sprawia, że mogą kolonizować różne podłoża, w tym również materiały wykorzystywane w budownictwie.
Zjawisko związane z zasiedleniem przez grzyby pleśniowe powierzchni przegród i elementów budynków określane jest jako biodeterioracja – pod terminem tym należy rozumieć utratę właściwości użytkowych obiektu budowlanego w wyniku aktywności czynników biologicznych, a także emisji do powietrza zarodników, fragmentów grzybni oraz produktów metabolizmu grzybów, czyli mikotoksyn oraz związków lotnych. Porażenie budynku grzybami pleśniowymi niesie zatem za sobą nie tylko degradację budynku, ale przede wszystkim czynnik zagrożenia dla przebywających w nim ludzi, podrażniając drogi oddechowe, wywołując alergię, a nawet działając rakotwórczo [2, 3].
|
O czym przeczytasz w artykule:
|
W artykule przedstawiono podział grzybów pleśniowych oraz wymieniono warunki sprzyjające rozwojowi grzybów pleśniowych w budynku. Opisano cele renowacji antypleśniowej.
Objectives and control of anti-mold renovation in damp spaces The article presents the division of mould fungi and lists the conditions conducive to the development of mold fungi in the building. The objectives of anti-mold renovation are described. |
O rozwoju (lub jego braku) grzybów pleśniowych w budynku decydują takie czynniki jak [1]:
- zakres temperatury,
- odczyn pH podłoża oraz odporność na substancje chemiczne
- zapotrzebowanie na substancje odżywcze,
- stosunek do tlenu,
- wilgotność podłoża.
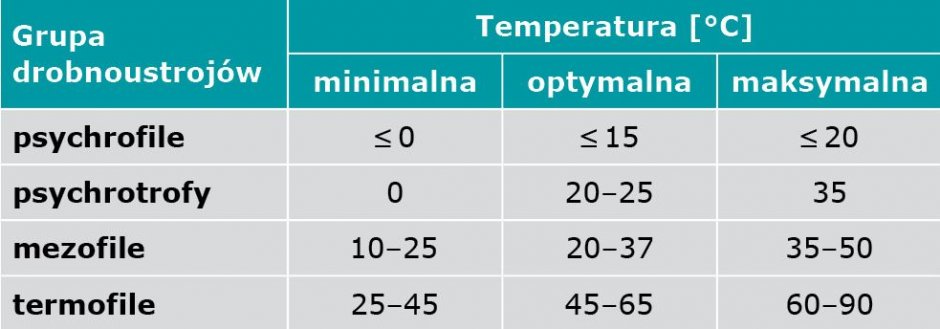
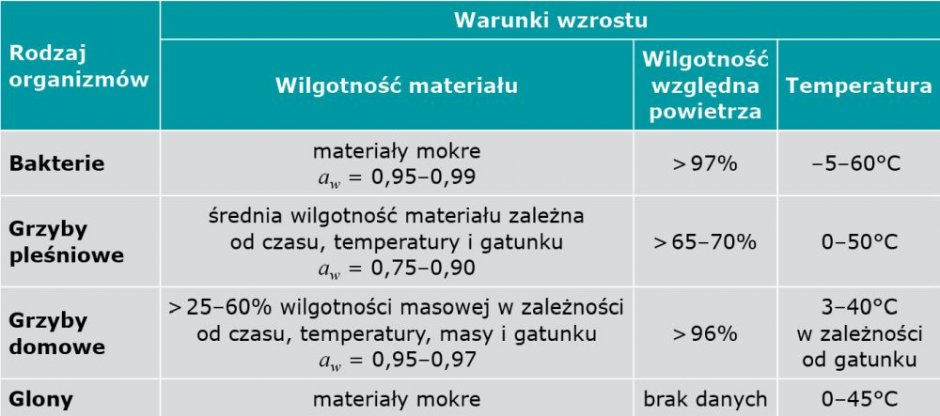
Choć grzyby pleśniowe wykazują wzrost w bardzo szerokim spektrum temperatury (od –12 do +60°C), większość gatunków należy do grupy drobnoustrojów określanych jako mezofile, czyli organizmów, których optymalna temperatura wzrostu mieści się w tym samym zakresie co temperatura komfortu cieplnego w mieszkaniach (TABELA 1). W większym stopniu są też wrażliwe na bardzo wysoką niż bardzo niską temperaturę [2].
Pleśnie wykazują dużą tolerancję na odczyn pH środowiska. Najlepsze warunki do ich rozwoju, jako organizmów acidofilnych, zapewnia środowisko lekko kwasowe (pH w zakresie od 5 do 6). Niektóre gatunki mogą się jednak rozwijać w szerokim zakresie wartości pH (od 1 do 10). Dopiero wartość pH powyżej 10 (np. tynki i farby wapienne) uniemożliwia wzrost tych organizmów [1, 3].
Jako organizmy oligotroficzne charakteryzują się niewielkimi wymaganiami pokarmowymi. Większość z nich należy do grupy saprofitów, tj. wykorzystuje martwą tkankę organiczną. Jednak już jej niewielka ilość (przy odpowiedniej wilgotności oraz temperaturze) jest wystarczająca do zainicjowania wzrostu – w budynkach znajdują jej odpowiednią ilość w postaci materii organicznej zawartej w kurzu, a także składników materiałów budowlanych i wykończeniowych [2].
Pleśnie należą do organizmów tlenowych, co objawia się ich powierzchniowym rozwojem na bardzo zróżnicowanych podłożach (zarówno płynnych, jak i stałych). Ich strzępki mogą penetrować w głąb podłoża, niemniej jedynie wówczas, gdy jego struktura jest odpowiednio porowata, względnie uszkodzona. Istnieją gatunki, które tolerują niedobór tlenu w środowisku (mogą zatem przetrwać w głębszych warstwach materiałów technicznych), większość pleśni jest jednak wrażliwa na wysokie stężenie dwutlenku węgla [1, 2].
Kluczowym elementem determinującym rozwój grzybów pleśniowych w budynkach jest zawartość wody w środowisku [1], przy czym na powstawanie i kiełkowanie zarodników oraz wzrost grzybni pleśni w największym stopniu wpływa zawilgocenie podłoża [3–7]. Jednak to nie całkowita wilgotność materiału jest decydująca, a woda „swobodnie dostępna dla pleśni”. Jest to woda zawarta w porach oraz na powierzchni elementu, która nie jest związana przez np. sole [8].
Dla tej wody swobodnej mikrobiolodzy posługują się pojęciem aktywności wody, wyrażanym przez współczynnik αw. Jest on definiowany jako iloraz ciśnienia pary wodnej w lub na materiale stanowiącym pożywkę grzybów pleśniowych (pD) i ciśnienia nasyconej pary wodnej (ps) w tej samej temperaturze [1, 8]:
W stanie równowagi aktywność wody można wyrazić poprzez wilgotność względną. Jednakże w przeciwieństwie do wilgotności względnej, która wyrażana jest w procentach, wartość współczynnika aw odnosi się do stanu nasycenia (wartości równej 1). Na przykład wartość αw = 0,80, odpowiadająca wilgotności względnej 80%, jest jedynie miarą tworzenia się warstewki wilgoci na lub bezpośrednio nad powierzchnią elementu [8].
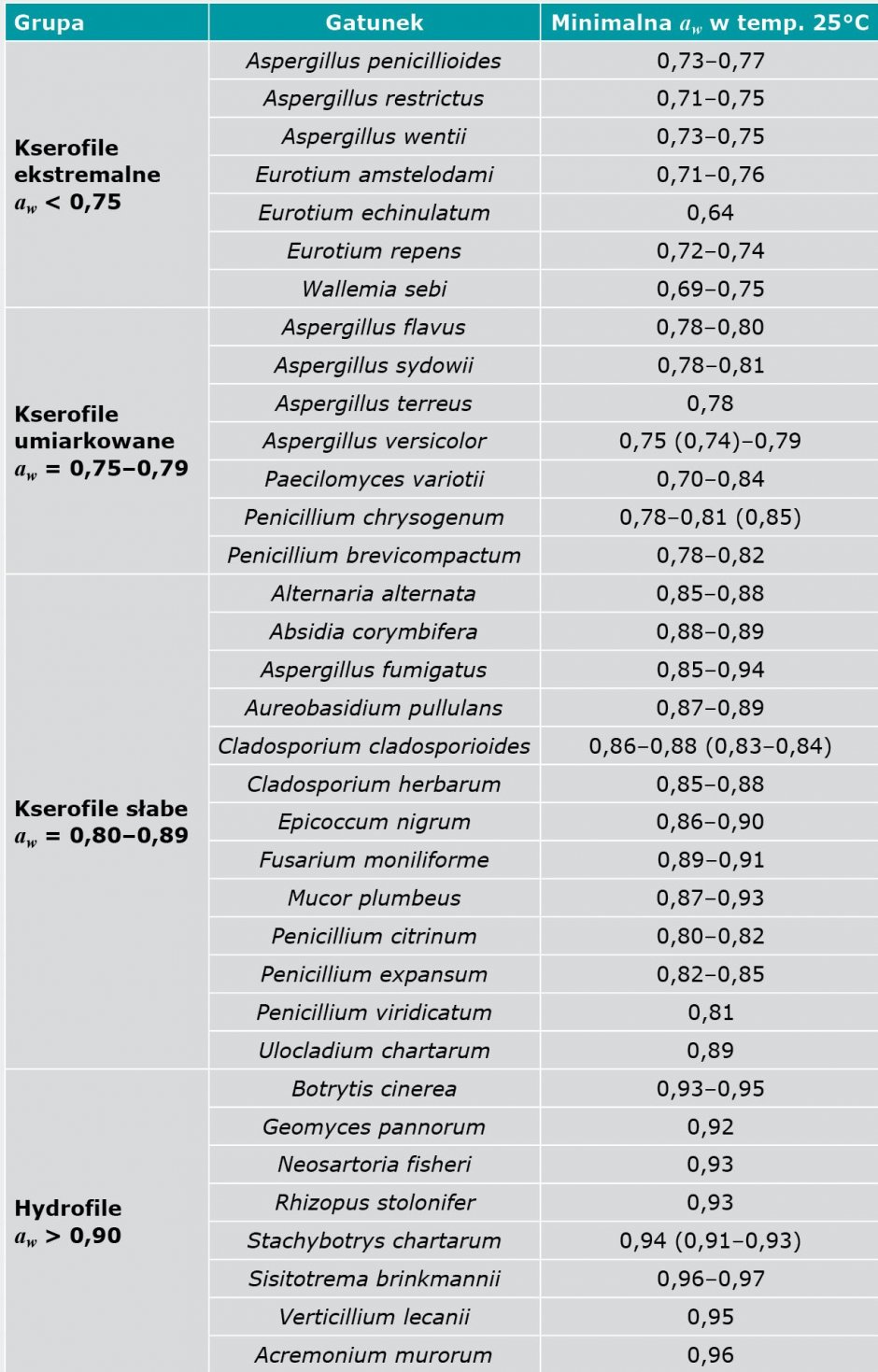
Choć większość grzybów pleśniowych preferuje podłoża o wartości αw od 0,80 do 0,89 (TABELA 2), występują również tzw. pleśnie ekstremalnie kserofilne, które mogą rozwijać się na bardziej suchych podłożach o wartości αw ≤ 0,70, a nawet takie (np. Eurotium echinulatum), które rozwijają się na substratach o wartości αw na poziomie 0,64.
Rozwój pleśni na tak suchych powierzchniach wymaga jednak, aby na substracie (podłożu) utworzył się hydrofilowy biofilm, który wiąże wilgoć i w ten sposób odpowiednio zasila zarodniki pleśni. Wymóg ten nie musi być spełniony w przypadku Penicillium chrysogenum i Aspergillus restrictus.
Pleśnie hydrofilowe, takie jak Stachybotrys chartarum, rozwijają się na podłożach o wysokiej aktywności wody od 0,90 do 0,95 [1, 8].
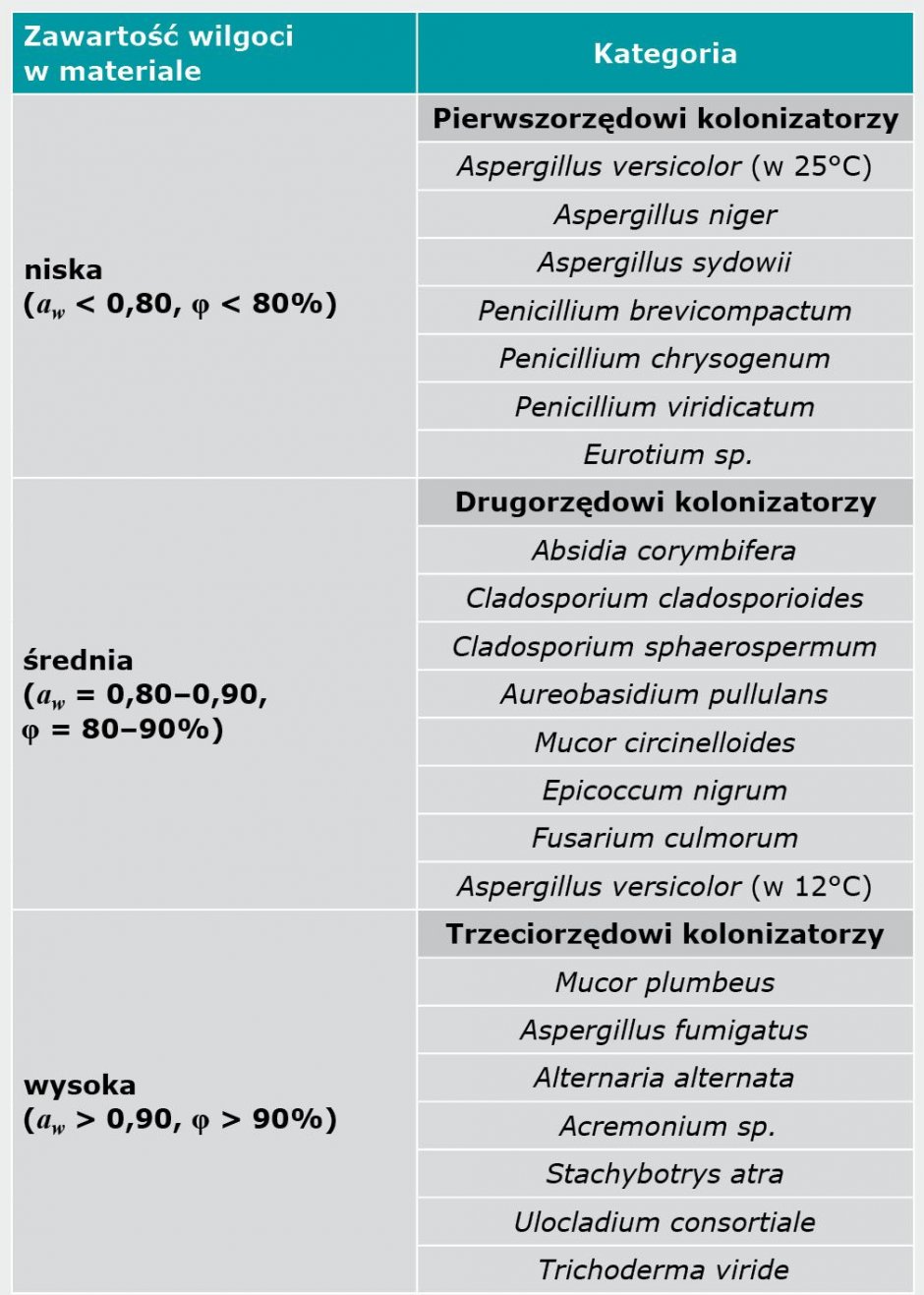
Na podstawie prowadzonych w środowisku naturalnym obserwacji, jak również badań laboratoryjnych określających minimalne oraz maksymalne wartości aktywności wody αw, opracowano klasyfikację grzybów pleśniowych kolonizujących materiały budowlane, wprowadzając podział na kolonizatorów pierwszo-, drugo- oraz trzeciorzędowych (TABELA 3). Podział ten należy jednak traktować jako umowny, materiał zawilgocony w bardzo dużym stopniu (αw > 0,90) zostanie bowiem skolonizowany w pierwszej kolejności przez hydrofilne gatunki zaliczane do kolonizatorów trzeciorzędowych [1, 2].
Obok zawartości wilgoci w podłożu, kluczowym parametrem decydującym o warunkach wzrostu grzybów pleśniowych jest wilgotność względna otaczającego powietrza. TABELA 4 przedstawia parametry wilgotnościowe, zarówno w odniesieniu do materiału, jak i otaczającego powietrza, oraz spektrum temperatury sprzyjające rozwojowi grzybów pleśniowych oraz innych czynników biologicznych w budynku [1].
Względna wilgotność powietrza w połączeniu z temperaturą powietrza oraz przegrody w znaczący sposób wpływa na zawilgocenie podłoża poprzez kondensację pary wodnej [9].
Na podstawie porównania zróżnicowanych preferencji grzybów pleśniowych dotyczących wilgotności można stwierdzić, że nie należy ich traktować jako całość, ale że każdy gatunek ma swoje charakterystyczne dla tworzenia i wzrostu zarodników widmo wilgotności lub widmo wartości współczynnika αw.
Tworzenie zarodników wegetatywnych lub płciowych wymaga wyższych wartości niż wzrost grzybni lub kiełkowanie zarodników. Zasadniczo nie wiadomo, czy tworzenie toksyn w pleśniach toksykogennych zaczyna się dopiero przy wyższych wartościach αw. W związku z tym, wraz z usuwaniem wilgoci pleśń jest nie tylko pozbawiona środków do życia, ale przede wszystkim szkodliwych i zagrażających zdrowiu właściwości [8].
Zwiększone występowanie niektórych rodzajów pleśni może być również wykorzystywane do oceny stanu zawilgocenia obiektu. Zarodniki konidialne gatunków Aspergillus i Penicillium mogą przez lata pozostawać żywotne w stanie suchym. Z kolei zarodniki gatunku Mucor są znacznie bardziej wrażliwe na zmiany wilgotności. W przypadku pleśni mezofilnych tworzenie się wilgoci kondensacyjnej przez trzy do czterech kolejnych dni jest zwykle wystarczające, aby kiełkować i ponownie utworzyć grzybnię.
W oparciu o zależność między wzrostem a tworzeniem zarodników pleśni z jednej i ocenie aktywności wody podłoża z drugiej strony, określenie rodzaju pleśni wykorzystywane jest we współczesnej diagnostyce jako wskaźnik zawilgocenia. Obecność pleśni o szczególnie wysokim zapotrzebowaniu na wilgoć stanowi bowiem indykator ukrytych uszkodzeń spowodowanych wilgocią. Wymaga to jednak wysokiego poziomu wiedzy [8].
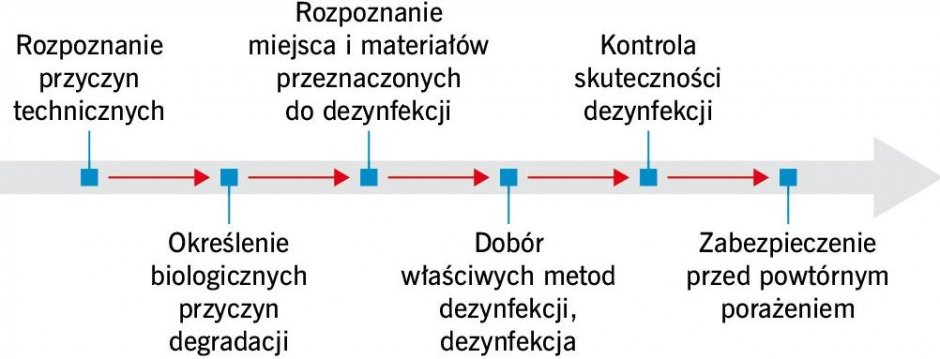
Skuteczne usunięcie grzybów pleśniowych (jak również innych organizmów zasiedlających budynki) wymaga przeprowadzenia kilkuetapowego procesu (RYS.), którego elementem powinno być również zabezpieczenie materiałów budowlanych przed ponownym porażeniem biologicznym [1].
Przez renowację materiałów skolonizowanych przez pleśń (potocznie określaną jako renowacja antypleśniowa) rozumiemy usuwanie pokrytych grzybami materiałów i czyszczenie skażonych powierzchni. Przy wykonywaniu prac renowacyjnych należy zwrócić uwagę na odpowiednią ochronę środowiska na placu budowy, jak również aktualny stan techniki w zakresie bezpieczeństwa i higieny pracy.
Przedstawione poniżej cele oraz sposób kontroli przeprowadzenia renowacji pomieszczeń skażonych grzybami pleśniowymi opisano w znowelizowanej w 2021 r. instrukcji WTA nr 4-12-21/D [10]. W jej myśl cel renowacji antypleśniowej stanowi z reguły usunięcie porośniętych pleśnią materiałów lub przywrócenie ich do „stanu normalnego”, jak również oczyszczenie powierzchni, które mogły zostać zanieczyszczone, w takim stopniu, aby nadawały się do zamierzonego stosowania.
Aby cel renowacji został nie tylko osiągnięty, ale i zachowany, należy trwale usunąć przyczynę wynikającą z fizyki budowli.
Przez stan normalny należy rozumieć sytuację, że materiał nie jest porośnięty pleśnią, jak również nie występuje skażenie biologiczne przekraczające pewny poziom. Należy przy tym dokonać rozróżnienia pomiędzy rozwojem pleśni na materiale (rozwój drobnoustrojów zachodzi lub zachodził) oraz zanieczyszczeniem powierzchni składnikami pleśni (np. poprzez sedymentację zarodników lub innych składników mikrobiologicznych). Z reguły za odstępstwo od stanu normalnego uznaje się widoczne zanieczyszczenie pleśnią oraz występowanie zapachu stęchlizny.
Podstawowym celem renowacji antypleśniowej jest usunięcie skażonych materiałów oraz oczyszczenie zanieczyszczonych powierzchni. W przypadku powierzchni nadających się do czyszczenia, zazwyczaj wystarczające jest czyszczenie mechaniczne za pomocą odpowiednich odkurzaczy przemysłowych lub środków wiążących kurz (np. wycieranie na wilgotno).
W przypadku porośniętych pleśnią materiałów, które można usunąć jedynie przy zastosowaniu zaawansowanych, nieproporcjonalnych metod, cel naprawczy może również stanowić wykonanie odpornej na skażenie biologiczne hydroizolacji.
Warunkiem prawidłowego uszczelnienia jest to, że:
- izolacja pozostanie trwale szczelna,
- potwierdzenie pomiarami, że uszkodzone elementy w obrębie przegrody są trwale oraz wystarczająco suche (z reguły poniżej 80% wilgotności względnej).
O ile nie ustalono inaczej, celem renowacji antypleśniowej powinno być całkowite usunięcie pleśni z elementu budowlanego lub jego powierzchni, co z reguły oznacza również, że zaatakowane przez grzyby materiały lub warstwy materiałów powinny być w całości usunięte.
Z uwagi na ryzyko powstawania nieprzyjemnych zapachów, jak również na możliwe zagrożenie dla zdrowia użytkowników, przeprowadzenie dezynfekcji za pomocą biocydów w większości przypadków nie jest konieczne. Ma ono sens jedynie wówczas, gdy celem jest zabezpieczenie przed dalszymi uszkodzeniami przed lub w trakcie prowadzonych prac.
Z uwagi na możliwy negatywny wpływ biocydów na materiały budowlane oraz na zdrowie użytkowników, ich użycie powinno być w każdym przypadku pisemnie uzasadnione, a skuteczność środków dezynfekcyjnych należy w odpowiedni sposób udowodnić.
Pierwszym krokiem oceny skuteczności renowacji antypleśniowej powinna być przeprowadzona przez niezależnego eksperta ocena wizualna (która powinna mieć też pierwszeństwo przed badaniami materiałów i powierzchni). Podczas oględzin należy w pierwszym rzędzie ustalić, czy:
- skażone pleśnią materiały/warstwy zostały w wystarczającym stopniu usunięte,
- występują nietypowe zapachy związane ze skażeniem pleśnią,
- czy w wyniku podjętych działań osiągnięto oczekiwany stan normalny.
Jeśli już na etapie oceny wizualnej zostaną stwierdzone uchybienia w wykonaniu, muszą być one bezzwłocznie usunięte. Dalsze badania metrologiczne stanowią konieczność, jeśli kontrola wzrokowa nie może zostać w odpowiedni sposób przeprowadzona lub gdy zgodnie z koncepcją remontu przewidziano badanie powietrza w pomieszczeniu. Badania takie można przeprowadzić poprzez pobranie próbek materiałów, względnie za pomocą badania powietrza w pomieszczeniach.
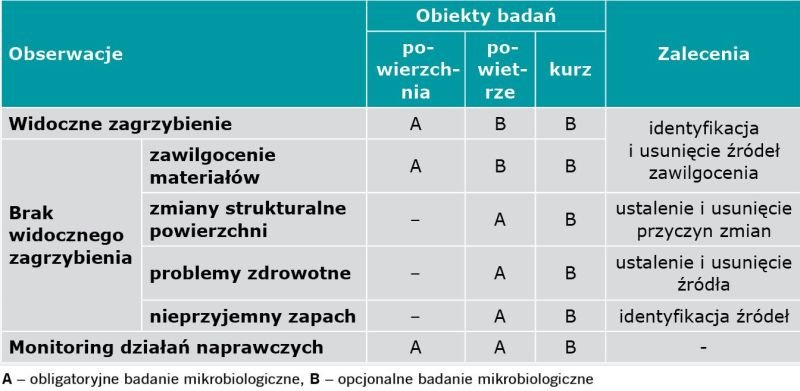
Przed przystąpieniem do obu rodzajów badań należy opracować strategię poboru próbek, która będzie zawierać zrozumiałą podstawę do oceny wyników (TABELA 5).
Badania pobranych próbek (preferowane są badania mikroskopowe) można wykorzystać do oceny, czy zainfekowane powierzchnie zostały usunięte na odpowiednią głębokość. Do oceny zanieczyszczenia powierzchni przez grzyby najczęściej stosowane są metody hodowlane, wykorzystujące pożywki mikrobiologiczne. W trakcie badania grzyby ujawniają się na pożywce w postaci kolonii, a wynik badania podaje się zazwyczaj jako ilość jednostek tworzących kolonię (jtk) przypadających na 100 cm2 powierzchni lub (w przypadku materiału stałego) na 1 g masy próbki, natomiast w przypadku pomiaru składu powietrza wynik podaje się jako jtk/m3 [1].
Ocena, czy materiał jest zainfekowany pleśnią, może opierać się na wartościach referencyjnych lub przez porównanie z materiałem niezanieczyszczonym.
Pomiary składu powietrza w pomieszczeniu mogą służyć do sprawdzenia, czy osiągnięta została uzgodniona docelowa jakość powietrza. Pobrane w pomieszczeniach próbki powietrza poddawane są ocenie mikroskopowej przez specjalistyczne laboratorium. Z reguły na proces ten składają się dwa kroki:
- mobilizacja,
- pobieranie próbek zarodników.
W przypadku uznania za konieczne wykonanie pomiarów referencyjnych proces rozłożony zostaje na trzy etapy:
- pobieranie próbek zarodników bez mobilizacji (pomiar referencyjny),
- mobilizacja,
- pobieranie próbek zarodników.
Pomiar jakości powietrza w „cichym” pomieszczeniu (przed mobilizacją) może stanowić wartość referencyjną dla pomiaru powietrza po mobilizacji – porównanie to pozwala wykazać, jaka część zarodników, które mogą zostać zmobilizowane, pozostała na oczyszczonych powierzchniach, a tym samym umożliwia ocenę dokładności wykonanego czyszczenia.
Pomiar referencyjny (tj. pomiar całkowitej ilości zarodników w stanie spoczynku) wykonuje się nie wcześniej niż 12 godz. po zakończeniu prac związanych z renowacją antypleśniową oraz po wyłączeniu wszystkich urządzeń wywołujących ruch powietrza.
Po wykonaniu pomiaru referencyjnego przeprowadza się mobilizację, a następnie (ok. 10 min później) wykonuje się kolejny pomiar powietrza w tym samym punkcie.
Jeśli podczas wykonywania prac remontowych dochodziło do regularnej wymiany powietrza pomiędzy miejscem pracy a atmosferą zewnętrzną (ale bez użycia technicznych urządzeń wentylacyjnych), przydatny może okazać się dodatkowy pomiar powietrza zewnętrznego (należy mieć jednak na uwadze, że stężenia zarodników w powietrzu zewnętrznym podlegają silnym wahaniom). Lokalizację pomiaru należy w takiej sytuacji wybrać tak, aby została próbka powietrza napływającego do obiektu w normalnych warunkach. Miejsce pomiaru powinno być ponadto usytuowane w taki sposób, aby zachować odpowiednią odległość od źródeł drobnoustrojów (koszy na śmieci, kompostowników, magazynów lub krzaków). Należy ponadto unikać pobierania próbek w trakcie opadów deszczu lub krótko po ich ustaniu.
Czas pomiaru referencyjnego powietrza zewnętrznego musi być powiązany z pomiarem powietrza w pomieszczeniu i nie powinien przekraczać czterech godzin.
Mobilizację zarodników przeprowadza się poprzez ukierunkowane nadmuchy na otaczające powierzchnie, przez co osadzone cząstki są uwalniane do powietrza w pomieszczeniu, a dzięki temu można je wykryć za pomocą pomiaru powietrza.
W przypadku pomieszczeń o normalnej wysokości mobilizację należy wykonywać przy użyciu wentylatora na co najmniej 50% powierzchni, z natężeniem przepływu wynoszącym od 1 do 4 m/s. Mobilizacja musi nastąpić przed pobraniem próbek – pomiary powietrza w pomieszczeniach bez mobilizacji powierzchni prowadzą do nieokreślonych i niepowtarzalnych wyników.
Pomiary powietrza w pomieszczeniach przeprowadzane są 10 min po mobilizacji i można je wykonać jedynie wówczas, gdy podczas mobilizacji nie uwalnia się widoczny makroskopowo kurz (który może powodować zafałszowanie wyników). Pomiary należy przeprowadzać osobno w każdym pomieszczeniu. Liczba próbek powinna być reprezentatywna do badanej powierzchni. W przypadku pomieszczeń do 100 m2 wystarczająca jest mobilizacja przy użyciu wentylatora. W przypadku pomieszczeń znacznie większych niż 100 m2 należy je podzielić na mniejsze „komórki”.
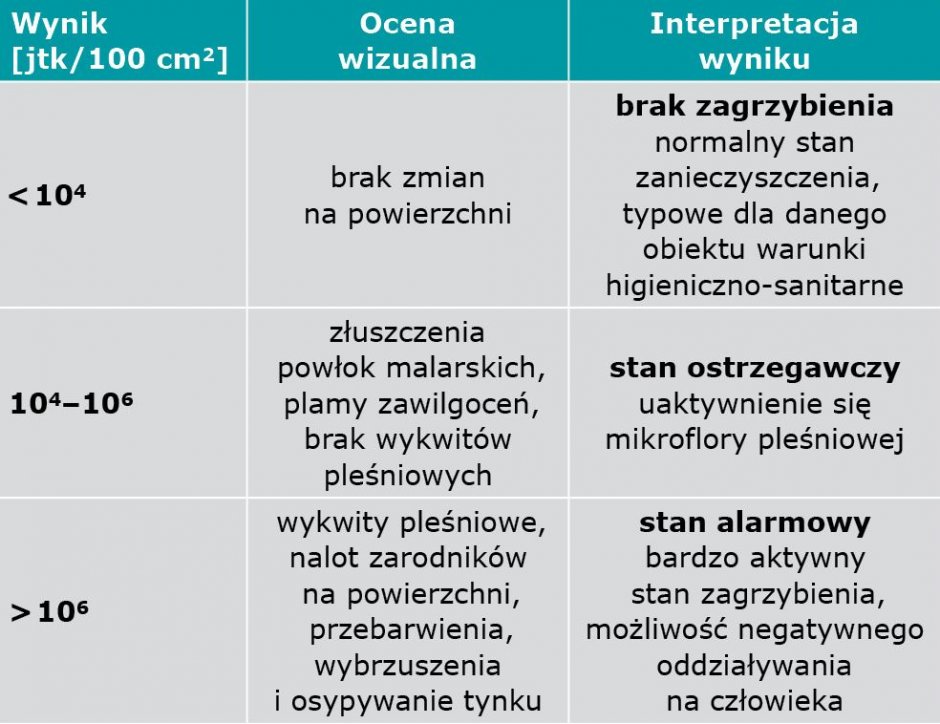
W Polsce nie ustalono prawnie poziomu dopuszczalnego zanieczyszczenia powierzchni oraz podłoża przez grzyby pleśniowe. Brak też kryteriów określających dopuszczalne zanieczyszczenie mikrobiologiczne powietrza w budynkach. W literaturze jako kryterium pozwalające na rozróżnienie stanu aktywnego rozwoju grzybów od sytuacji, gdy zarodniki jedynie sedymentują wraz z kurzem na powierzchnie (a ich rozwój widoczny jest dopiero na pożywce biologicznej), jest wartość 104 jtk/100 cm2 (TABELA 6).
W przypadku powietrza wewnętrznego Zespół ekspertów ds. biologicznych Międzyresortowej Komisji do Spraw Najwyższych Dopuszczalnych Stężeń i Natężeń Czynników Szkodliwych dla Zdrowia w Środowisku Pracy jako dopuszczalny dla pomieszczeń użyteczności publicznej oraz mieszkalnych zaproponował stan, w którym ogólna liczba grzybów nie przekracza wartości 5×103 jtk/m3. Proponowane w literaturze akceptowalne poziomy dla pomieszczeń mieszkalnych mieszczą się w zakresie 10–104 jtk/m3, natomiast najczęściej jako akceptowalny uznawany jest poziom 102 jtk/m3 [1].
Elementem kontroli renowacji antypleśniowej jest ponadto ocena skuteczności suszenia przegród budowlanych (badanie wilgotności materiałów) [12].
Literatura
1. B. Gutarowska, M. Piotrowska, A. Koziróg, „Grzyby w budynkach. Zagrożenia, ochrona, usuwanie”, Wydawnictwo Naukowe PWN, Warszawa 2019.
2. J. Karyś (red.), „Ochrona przed wilgocią i korozją biologiczną w budownictwie”, Grupa MEDIUM, Warszawa 2014.
3. B.J. Rouba, „Pielęgnacja świątyni i innych zabytków. Książka nie tylko dla księży”, Wydawnictwo Naukowe Uniwersytetu Mikołaja Kopernika, Toruń 2014.
4. M. Trochonowicz, „Wilgoć w obiektach budowlanych. Problematyka badań wilgotnościowych”, „Budownictwo i Architektura” 7/2010, s. 131–144.
5. J. Adamowski, „Metodyka badań zawilgoconych murów”, „Materiały Budowlane” 7/2005, s. 6–8.
6. K. Pawłowski, „Jakość cieplna przegród i złączy budowlanych budynków z uwzględnieniem wymagań obowiązujących od 1 stycznia 2021 r.”, „IZOLACJE” 11/12/2020, s. 22–34.
7. J. Hoła, Z. Matkowski, „Przyczyny i skutki nadmiernego zawilgocenia murów ceglanych na przykładzie obiektów zabytkowych”, „Materiały Budowlane” 3/2009, s. 14–17.
8. F. Frössel, „Mauerwerkstrockenlegung und Kellersanierung. Wenn das Haus nasse Füße hat“, Fraunhofer IRB Verlag, Stuttgart 2012.
9. B. Monczyński, „Przyczyny zawilgacania budynków”, „IZOLACJE” 1/2020, s. 88–93.
10. WTA Merkblatt 4-12-21/D, „Ziele und Kontrolle von Schimmelpilzschadensanierungen in Innenräumen, Wissenschaftlich-Technische Arbeitsgemeinschaft für Bauwerkserhaltung und Denkmalpflege“, e.V., 2021.
11. PN-EN ISO 16000-19:2014-12, „Powietrze wnętrz. Część 19: Strategia pobierania próbek pleśni”.
12. B. Monczyński, „Badanie wilgotności mineralnych materiałów budowlanych”, „IZOLACJE” 2/2019, s. 78–84