Nowa metoda oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków na elewacjach zewnętrznych

Jak długo zastosowany na elewacji tynk będzie wyglądał estetycznie? fot. Pixabay
Czy można przewidzieć, jak długo zastosowany na elewacji zewnętrznej tynk będzie wyglądał estetycznie? To pytanie nurtuje wielu inwestorów, spółdzielnie mieszkaniowe oraz właścicieli domów jednorodzinnych i pojawia się w branży budowlanej coraz częściej, m.in. ze względu na wdrażanie idei budownictwa zrównoważonego bazującego na materiałach pochodzenia naturalnego [1]. Wykorzystanie tego typu materiałów ma zmniejszyć wpływ sektora budowlanego na środowisko i obniżyć emisję dwutlenku węgla, ale nie wiadomo, czy będą one równie trwałe jak materiały tradycyjne.
*****
Zmiany estetyczne na elewacjach budynków są najczęściej spowodowane rozwojem grzybów i glonów. Mikroorganizmy te wywołują zjawisko biodeterioracji, czyli biologicznego niszczenia materiałów. W przypadku tynków zewnętrznych zabezpieczonych biocydami, które ograniczają wzrost mikroorganizmów, ważne jest określenie czasu oporności materiałów budowlanych na porastanie przez glony i grzyby. Dotychczas nie opracowano wystandaryzowanych metod badania trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków na elewacjach zewnętrznych. Ważne jest, aby takie metody uwzględniały aspekty środowiskowe związane ze zmianą właściwości biocydów w trakcie użytkowania materiałów budowlanych w warunkach rzeczywistych. W artykule przedstawiono nową metodę oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych, która uwzględnia aspekty oświetlenia, wypłukiwania biocydów wodą, obecności materii organicznej na powłokach oraz gęstości komórek i rodzaju mikroorganizmów osiadających na elewacjach. Przedstawiono także perspektywy rozwoju metody w oparciu o zastosowanie cyfrowych metod analizy obrazu do oceny wizualnej stopnia porośnięcia próbek przez mikroorganizmy.
New method for assessing the durability of antifungal and algicidal protection of external plaster on facades
Aesthetic changes on building facades are most commonly caused by the development of fungi and algae. These microorganisms induce the phenomenon of biodeterioration, which is the biological degradation of materials. In the case of external plasters protected with biocides, which limit the growth of microorganisms, it is important to determine the resistance time of building materials to colonization by algae and fungi. So far, standardized methods for testing the durability of antifungal and algicidal protection of plasters on external facades have not been developed. It is important that such methods take into account environmental aspects related to the change in the properties of biocides during the use of building materials in real conditions. The article presents a new method for assessing the durability of antifungal and algicidal protection of building plasters, which considers aspects such as lighting, leaching of biocides with water, the presence of organic matter on coatings, as well as the density of cells and the type of microorganisms settling on facades. The article also presents the prospects for the development of the method based on the application of digital image analysis methods to visually assess the degree of colonization of samples by microorganisms.
*****
Najczęściej przyczyną niepożądanych zmian wizualnych na elewacjach budynków jest wzrost mikroorganizmów wywołujących zjawisko biodeterioracji, czyli biologicznego niszczenia materiałów budowlanych [2]. Główną przyczyną biodegradacji materiałów budowlanych, znajdujących się w środowisku zewnętrznym, są glony i grzyby [3, 4]. Jest to spowodowane ich powszechnością występowania w środowisku (gleba, powietrze atmosferyczne, rośliny) oraz przystosowaniami do zasiedlania tego typu materiałów (wytwarzanie spor, przeżywalność w niskiej aktywności wody, mała wrażliwość na promieniowanie UV, zmiany temperatury) [5, 6]. Ponadto glony są zdolne do wiązania węgla atmosferycznego i zwykle są pierwszymi organizmami kolonizującymi elewacje budynków.
Czytaj też o: Wyprawach tynkarskich w systemach ETICS
Oczywistą konsekwencją biodeterioracji materiału budowlanego jest osłabienie jego właściwości użytkowych: wytrzymałość na rozciąganie, pękanie, pękanie i wżery, a także utrata koloru czy przebarwienia (działanie barwników wytwarzanych przez pleśnie i glony m.in. karotenoidy, melanina, chlorofil) [7–11]. O ile to właśnie pleśnie najczęściej kojarzone są z chemicznym mechanizmem ataku na pokrywane powierzchnie (np. wżery), o tyle obecność glonów skutkuje przede wszystkim zmianami estetycznymi (tworzenie przebarwień, patyn i śluzowatych powierzchni), zwiększeniem nasiąkliwości oraz tworzeniem złożonych, ciężkich do usunięcia biofilmów [10–13]. Niesie to za sobą poważne straty ekonomiczne i środowiskowe związane z myciem i dezynfekcją, a czasem wymianą elewacji.
Obecnie znanych jest wiele metod oznaczania zanieczyszczenia mikrobiologicznego na materiałach budowlanych, w tym metody tradycyjne (hodowle na pożywkach mikrobiologicznych), molekularne [reakcja łańcuchowa polimerazy (PCR) lub sekwencjonowanie nowej generacji (NGS)], chemiczne (pośrednie) obejmujące wykrywanie charakterystycznych składników komórek lub ich metabolitów [2, 14]. Metody te są używane najczęściej do badania historycznych budynków i materiałów budowlanych w silnie zagrzybionych pomieszczeniach, zdecydowanie rzadziej do elewacji zewnętrznych.
Niestety, dotychczas nie opracowano ujednoliconych, wystandaryzowanych metod badania czasu oporności materiałów budowlanych na porastanie przez glony i grzyby. Jest to kluczowe w przypadku nowych wyrobów, często zabezpieczonych biocydami, takimi jak np. czwartorzędowych solach amoniowe związki fotoaktywne, w tym TiO2 i ZnO2, sole metali (Ag, Cu i Zn) oraz nanocząstki metali (AgNPs, AuNPs i ZnONPs) [15–18]. Co prawda są normy (PN-EN 15457:2022-08 i PN-EN 15458:2022-08) [19, 20] pozwalające zbadać oporności materiałów budowlanych na wzrost grzybów i glonów, ale producenci nie są zobowiązani do ich stosowania. Ponadto, jak zauważył ostatnio Komar i wsp. [21], obecne metody badawcze całkowicie pomijają aspekty środowiskowe związane ze zmianą właściwości biobójczych i biostatycznych w trakcie użytkowania materiałów budowlanych w warunkach rzeczywistych, tj. okresowe naświetlanie UV, wymywanie biocydów, obecność dodatkowej substancji organicznej w postaci pyłów i oddziaływania innych parametrów związanych z ekspozycją zewnętrzną [21].
Bardzo często producenci deklarują, że ich materiały nie będą porastały przez określony czas, co nie jest poparte stosownymi badaniami i certyfikatami i w skrajnych przypadkach staje się przedmiotem sporów prawnych. Do takich sytuacji przyczyniać się może wiele czynników:
- brak laboratorium mikrobiologicznego w zakładzie produkującym materiały budowlane, w którym możliwa byłaby weryfikacja oporności na porastanie mikrobiologiczne,
- brak wymagań prawnych w zakresie badania materiałów budowlanych pod kątem biodeterioracji i bazowanie na danych teoretycznych dotyczących skuteczności biocydów,
- brak świadomości zmian aktywności przeciwglonowej/przeciwgrzybowej biocydów w czasie użytkowania modyfikowanych nimi materiałów.
W ostatnich latach do Katedry Biotechnologii Środowiskowej Politechniki Łódzkiej napływało wiele zleceń dotyczących wykonania ekspertyzy mającej na celu ocenę, czy przyczyną defektów estetycznych na elewacjach są mikroorganizmy oraz czy konkretny materiał, zgodnie z deklaracjami producentów, wykazuje działanie hamujące wzrost glonów/grzybów. Było to podstawą do opracowania w KBŚ PŁ metody oceny wzrostu glonów i grzybów na powłokach tynkarskich, które posłużą do wiarygodnego wyznaczania czasu zabezpieczenia tych materiałów przed biodeterioracją.
Nowa metoda oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych
Opracowano metodę oceny czasu trwałości zabezpieczenia przeciwgrzybowego tynków budowlanych przedstawioną na RYS.
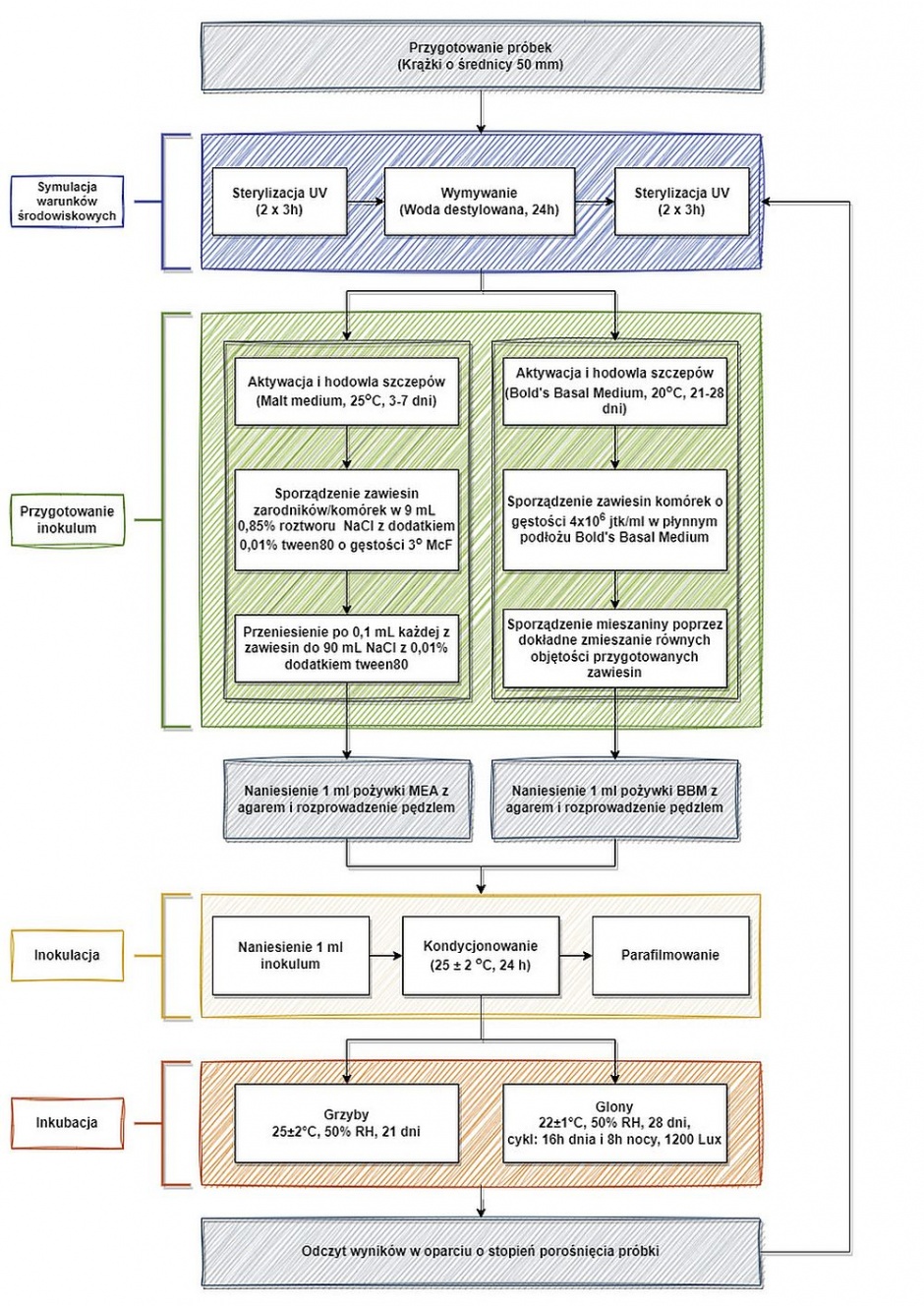
RYS. Sposób laboratoryjny oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych; fot.: J. Szulc, M. Komar, B. Gutarowska
Próbki badanych materiałów należy przygotować w postaci krążków o średnicy 50 mm (ułatwia to pracę w płytkach Petriego). Próbki w otwartych płytkach sterylizujemy światłem UV po 3 godz. z każdej strony. Etap ten pozwala zdezynfekować próbki pomiędzy cyklami badawczymi i umożliwi bezpieczną pracę z nimi w laboratorium.
Następnie próbki układamy w plastikowym pojemniku pojedynczo na dnie i moczymy w wodzie destylowanej przez 24 godz., tak aby cała powierzchnia próbek miała kontakt z wodą, a woda stanowiła warstwę o grubości 4 cm nad powierzchnią próbek. Moczenie próbek ma za zadanie symulowanie oddziaływania opadów atmosferycznych, a tym samym wymywania biocydów i innych substancji wchodzących w skład materiałów technicznych. Ilość wody do wymywania próbek ustalona została na podstawie danych statystycznych dotyczących opadów atmosferycznych w Polsce gromadzonych przez Instytut Meteorologii i Gospodarki Wodnej – Państwowy Instytut Badawczy (IMGW-PIB), Państwową Służbę Hydrologiczno-Meteorologiczną oraz Główny Inspektorat Ochrony Środowiska.
Następnie próbki przenosimy do płytek Petriego i w otwartych płytkach ponownie sterylizujemy światłem UV w komorze laminarnej po 3 godz. z każdej strony. Nie należy stosować termicznej sterylizacji ze względu na ryzyko dezaktywowania biocydów, jeśli będą badane próbki chemicznie modyfikowane. Naświetlanie próbek UV symuluje jednocześnie ekspozycję materiałów budowlanych na promieniowanie słoneczne.
Do przygotowania inokulum używamy pleśni Aspergillus niger (DSM 12634), Cladosporium cladosporioides i Penicillium citrinum (izolaty środowiskowe o potwierdzonej genetycznie przynależności taksonomicznej) oraz drożdży Rhodotorula mucilaginosa (DSM 70825). Gatunki te wskazywane są także w literaturze jako najczęściej izolowane z bioaerozolu w budynkach [22].
Zaktywowane grzyby hodujemy na płytkach z podłożem maltozowym w temperaturze 25°C ±2°C przez 3 dni (drożdże) i 7 dni (pleśnie). Zarodniki pleśni i biomasę drożdży zmywamy sterylną wymazówką i zawieszamy w probówce z 9 ml soli fizjologicznej (0,85% NaCl), z roztworem Tween 80 (0,01% v/v).
Za pomocą densytometru ustalamy gęstość optyczną dla szczepów testowych na poziomie 3 MF. Następnie przenosimy po 0,1 ml każdej z wystandaryzowanych zawiesin grzybów do 90 ml soli fizjologicznej z Tweenem 80. Sposób przygotowania inokulum zapewnia stężenie zarodników/komórek na poziomie ok. 3 × 104 jtk/mL i jest mniejsze niż obowiązujące w normie EN 15457 (106–107 jtk/mL).
Obniżenie stężenia grzybów w zawiesinie inokulacyjnej ma za zadanie odwzorować warunki rzeczywiste, w których materiały budowlane są narażone na ekspozycję na aerosol grzybowy o stężeniu < 3 × 104 jtk/m3.
W celach oznaczenia czasu trwałości zabezpieczenia przeciwglonowego postępujemy analogicznie. Do przygotowania inokulum wykorzystujemy trzy gatunki zielenic, tj. Stichococcus bacillaris, Pseudochlorella signiensis, Coenochloris signiensis oraz jeden gatunek sinicy Nostoc commune, powszechnie występujących na fasadach budowlanych w umiarkowanej strefie klimatycznej [21, 23].
Wyżej wymienione szczepy powinny być aktywowane (poprzez przeniesienie na nowe, optymalne do wzrostu podłoże BBM (Bold’s Basal Medium) i hodowane w temperaturze 22°C ±1°C przez 28 dni, stosując oświetlenie o natężeniu 1200 Lux w cyklu 16 godz. dnia i 8 godz. nocy. Po 28 dniach aktywnie rosnące szczepy należy zawiesić w płynnym podłożu BBM.
Stosując metody mikroskopowe (np. hemocytometr), dobrze wymieszaną zawiesinę każdego ze szczepów należy doprowadzić do gęstości 4×106 jtk/ml. Korektę gęstości wykonujemy, zawieszając za pomocą ezy większą ilość biomasy lub rozcieńczając płynnym podłożem. Następnie w nowym, sterylnym naczyniu mieszamy w równych objętościach sporządzone, wystandaryzowane zawiesiny, otrzymując mieszaninę inokulacyjną.
Na każdą z próbek nanosimy za pomocą pipety automatycznej 1 ml półpłynnej pożywki maltozowej (grzyby) lub pożywki Bolda (glony) i rozprowadzamy sterylnym miękkim pędzlem na całą powierzchnię próbki. Zastosowanie pędzla pozwala na równomierne rozprowadzenie minimalnej ilości pożywki na porowatej powierzchni próbek. Do każdego rodzaju próbek należy stosować oddzielny pędzel, aby nie przenosić zanieczyszczeń/biocydów. Następnie na każdą z próbek nanosimy po 1 ml inokulum i rozprowadzamy końcówką pipety. Próbki pozostawiamy na 24 godz. do wchłonięcia zawiesiny inokulacyjnej. Ostatecznie próbki zaklejamy parafilmem w celu zabezpieczenia przed wyschnięciem i umieszczamy w odpowiednich warunkach inkubacyjnych.
W celu oznaczenia oporności powłoki przed wzrostem pleśni, w cieplarce o temperaturze 25°C ±2°C i wilgotności powietrza 50% na okres 21 dni. W oznaczeniu trwałości zabezpieczenia przeciwglonowego zabezpieczone próbki umieszczamy w warunkach sztucznego oświetlenia o natężeniu 1200 Lux (16 godz. dnia i 8 godz. nocy), w temperaturze 22°C ±1°C, 50% względnej wilgotności powietrza i inkubujemy przez 28 dni.
W obu metodach wyniki należy odczytać metodą wizualną, korzystając ze skali ocen zamieszczonej w normie EN 15457, wg której dopuszczalna ocena „0” – oznacza brak wzrostu na powierzchni próbki; niedopuszczalna ocena „1” oznacza rozwój mikroorganizmów na co najmniej 10% powierzchni próbki.
Procedurę powtarzamy N razy aż do wystąpienia wzrostu przy założeniu, że jeden cykl badań odpowiada jednemu rokowi ekspozycji tynku w warunkach rzeczywistych, a liczba cykli, w których nie obserwuje się wzrostu, stanowi liczbę lat, w ciągu których tynk będzie odporny na wzrost tych mikroorganizmów.
Opisana metoda stanowi przedmiot zgłoszenia patentowego „Sposób laboratoryjny oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych” (Zgłoszenie: P.444942 [24]).
Laboratoryjna metoda oceny czasu trwałości tynków vs. warunki środowiskowe
W badaniach porównano rozwój grzybów w warunkach laboratoryjnych i w rzeczywistych warunkach środowiskowych dla siedmiu wybranych tynków po jednym, dwóch i trzech latach ekspozycji. Poletka doświadczalne (pionowe płyty betonowe pokryte badanymi tynkami) założono w 2019 r. w województwie małopolskim w zacienionym miejscu pomiędzy dwoma budynkami.
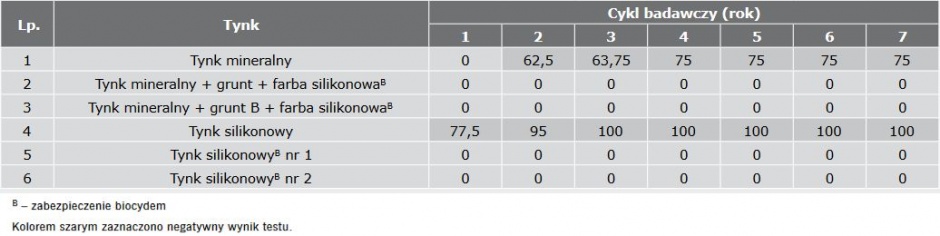
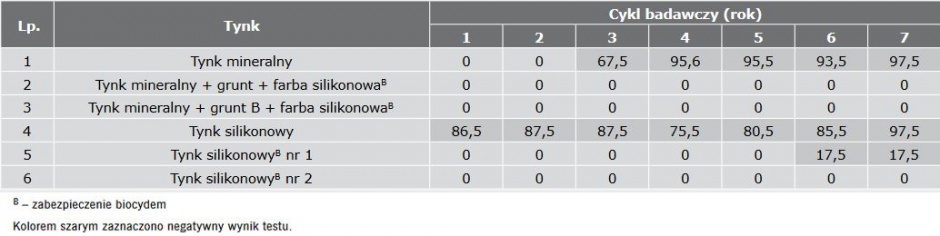
W TABELI 1 przedstawiono wyniki analizy czasu oporności tynków na porastanie przez grzyby w warunkach laboratoryjnych, a w TABELI 2 przez glony.
Wykazano, że materiały chronione biocydami, nie porastały przez siedem cykli badawczych w laboratorium, natomiast tynki mineralny, tynk mineralny z farbą silikonową oraz tynk silikonowy zarastały grzybami już po 1–2 cyklach, czyli ich przewidywalna trwałość wynosić będzie 1–2 lata.
W TABELI 3 zestawiono zdjęcia próbek laboratoryjnych po badaniu opracowaną metodą symulującą trzy lata użytkowania i zdjęcia tynków z poletka doświadczalnego.
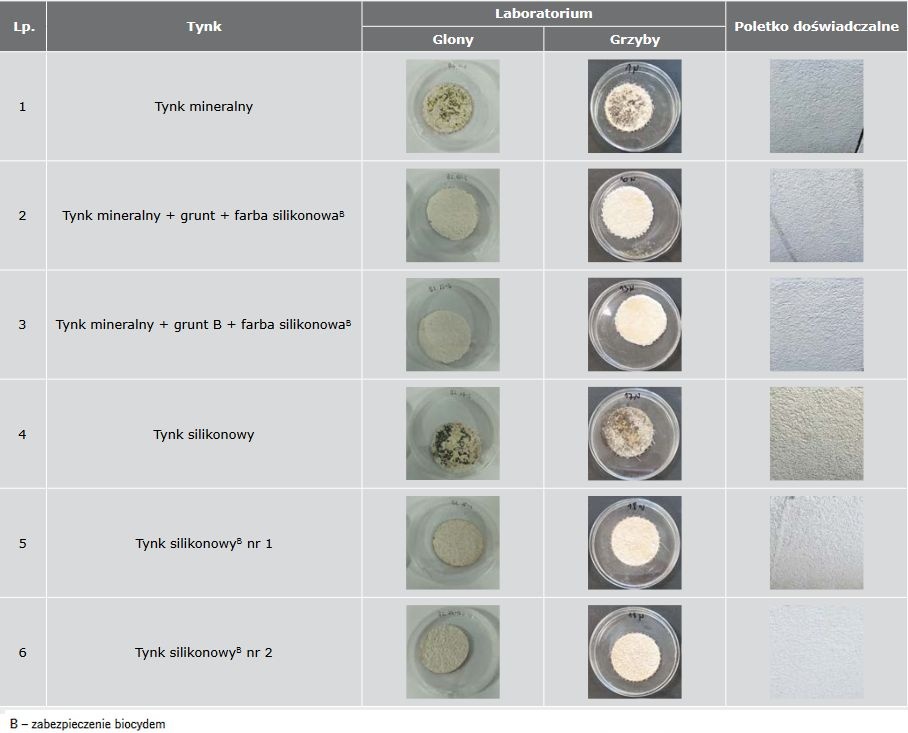
TABELA 3 Porównanie wyników badań laboratoryjnych porastania glonami i grzybami po 3 cyklach badawczych i 3 latach ekspozycji w warunkach środowiskowych
Badania wykazały, że opracowaną metodą można uzyskać wiarygodne wyniki dla większości badanych materiałów, z wyjątkiem tynku silikonowego bez biocydu (nr 4), który w warunkach laboratoryjnych zaczął porastać grzybami po jednym cyklu (roku), a w warunkach rzeczywistych po dwóch latach. Metodę należy nadal weryfikować pod kątem jej skuteczności w stosunku do innych rodzajów tynków modyfikowanych oraz tynków eksponowanych w różnych miejscach.
Perspektywy rozwoju opracowanej metodyki
Opracowana metoda jest wystarczająco uniwersalna, aby być powszechnie stosowana i jednocześnie pozwala na dalsze rozwijanie. Jednym z takich rozwiązań jest zastosowanie cyfrowych metod analizy obrazu do zmniejszenia subiektywności oceny wizualnej stopnia porośnięcia. Przykład takiej analizy, z wykorzystaniem programu ImageJ (licencja open source software – OSS) przedstawiono na FOT. 1 i FOT. 2.

FOT. 1. Obraz referencyjny próbki badawczej po procesie inkubacji. Widoczny wzrost glonów. Żółtym okręgiem zaznaczono granicę obszaru analizy powierzchni próby; fot.: J. Szulc, M. Komar, B. Gutarowska

FOT. 2. Analiza stopnia porośnięcia próbki badanej w programie ImageJ. Kolor czerwony symbolizuje obszary porośnięte przez glony. Wyliczony stopień porośnięcia: 25,27% całkowitej powierzchni próbki; fot.: J. Szulc, M. Komar, B. Gutarowska
Użyta metoda pozwoliła na zmniejszenie statystycznego błędu związanego z oceną stopnia porośnięcia powierzchni badanych próbek przy użyciu ludzkiego oka. Technika wymaga wyłącznie cyfrowego zdjęcia próbki po badaniu i umożliwia ręczną lub automatyczną selekcję obszarów zakażonych, wyliczanie procentowego stopnia pokrycia powierzchni, a także skalowanie do rzeczywistych rozmiarów obszarów porażonych. Takie rozwiązanie ułatwia standaryzację etapu oceny wyników, umożliwia wiarygodne wykonanie dokumentacji i potencjalnie pozwala na dalsze udoskonalenia np. z wykorzystaniem technik uczenia maszynowego.
Podsumowanie i wnioski
W ramach wieloletnich badań opracowano nową metodę oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych. Metoda ta uwzględnia czynniki środowiskowe, które oddziaływają na elewacje, takie jak: naświetlenie UV, wypłukiwanie biocydów wodą, obecność materii organicznej, gęstość komórek i rodzaj mikroorganizmów osiadających na elewacjach. Badania laboratoryjne nowej metody zostały potwierdzone w 3-letnim cyklu badań środowiskowych. Opracowano także cyfrową metodę analizy obrazu do oceny wizualnej stopnia porośnięcia próbek przez mikroorganizmy w warunkach laboratoryjnych. W kolejnych latach należy kontynuować badania w różnorodnych warunkach środowiskowych uwzględniających różny stopień zanieczyszczenia powietrza, ilość opadów, oświetlenie, a także rozszerzyć na inne materiały budowlane. Należy również dążyć do pełnej automatyzacji odczytu wyników laboratoryjnych.
Literatura
1. P. Brzyski, D. Barnat-Hunek, Z. Suchorab, G. Lagód, „Composite materials based on hemp and flax for low-energy buildings”. „Materials (Basel)”, 2017, 10, 510, doi:10.3390/ma10050510.
2. B. Gutarowska, „Metabolic activity of moulds as a factor of building materials biodegradation”, „Polish Journal of Microbiology” 2010, Vol. 59, No 2, 119ñ124, 2010; 59(2):119-124.
3. J. Szulc, T. Ruman, B. Gutarowska, „Metabolome profiles of moulds on carton-gypsum board and malt extract agar medium obtained using an AuNPET SALDI-ToF-MS method”, „International Biodeterioration & Biodegradation”, 2017, 125, 13–23, doi:10.1016/j.ibiod.2017.08.002. 125:13-23.
4. M. Komar, P. Nowicka-Krawczyk, T. Ruman, J. Nizioł, M. Dudek, B. Gutarowska, „Biodeterioration potential of algae on building materials – model study”, „International Biodeterioration & Biodegradation”, 2023, 180, 105593, doi: 10.1016/J.IBIOD.2023.105593. 180:105593.
5. F.L. Guerra. W. Lopes, J.C. Cazarolli, M. Lobato, A.B. Masuero, D.C.C. Dal Molin, F.M. Bento, A. Schrank, M.H. Vainstein, „Biodeterioration of mortar coating in historical buildings: microclimatic characterization, material, and fungal community”, „Building and Environment” 2019, 155, 195–209, doi: 10.1016/j.buildenv.2019.03.017.
6. B. Gutarowska, M. Piotrowska, „Methods of mycological analysis in buildings”, „Building and Environment” 2007, 42, 1843–1850, doi:10.1016/j.buildenv.2006.02.015.
7. C.C. Gaylarde, L.H.G. Morton, K. Loh, M.A. Shirakawa, „Biodeterioration of external architectural paint films – a review”, „International Biodeterioration & Biodegradation”, 2011, 65, 1189–1198.
8. K. Sterflinger, „Fungi: their role in deterioration of cultural heritage”, „Fungal Biology Reviews”, 2010, 24, 47–55.
9. B. Gutarowska, „Moulds in biodeterioration of technical materials”, „Folia Biologica et Oecologica”, 2014, 10, 27–39, doi: 10.2478/fobio-2014-0012.
10. A. Allsopp, D.; Seal, K.J.; Gaylarde, C.C. „Introduction to Biodeterioration”; 2nd ed.; Cambridge University Press: Cambridge, 2004; ISBN 9780521821353, https://doi.org/10.1017/CBO9780511617065.
11. P. Nowicka-Krawczyk, M. Komar, B. Gutarowska, „Towards understanding the link between the deterioration of building materials and the nature of aerophytic green algae”, „Science of the Total Environment” 2022, 802, 149856, doi:10.1016/j.scitotenv.2021.149856.
12. K. Rajkowska, A. Otlewska, A. Koziróg, M. Piotrowska, P. Nowicka-Krawczyk, M. Hachułka, G.J.Wolski, A. Kunicka-Styczyńska, B. Gutarowska, A. Żydzik-Białek, A. „Assessment of biological colonization of historic buildings in the former Auschwitz II-Birkenau concentration camp”, „Annals of Microbiology” 2014, 64, 799–808, doi: 10.1007/s13213-013-0716-8.
13. M. Komar, P. Nowicka-Krawczyk, T. Ruman, J. Nizioł, P. Konca, B. Gutarowska, „Metabolomic analysis of photosynthetic biofilms on building facades in temperate climate zones”, „International Biodeterioration & Biodegradation” 2022, 169, 105374, doi: 10.1016/j.ibiod.2022.105374.
14. T. Verdier, M. Coutand, A. Bertron, C. Roques, „A review of indoor microbial growth across building materials and sampling and analysis methods”, „Building and Environment” 2014, 80, 136–149.
15. L. Dyshlyuk, O. Babich, S. Ivanova, N. Vasilchenco, V. Atuchin, I. Korolkov, D. Russakov, A. Prosekov, „Antimicrobial potential of zno, TiO2 and SiO2 nanoparticles in protecting building materials from biodegradation”, „International Biodeterioration and Biodegradation”, 2020, 146, doi:10.1016/j.ibiod.2019.104821.
16. C. Moreau, V. Vergès-Belmin, L. Leroux, G. Orial, G. Fronteau, V. Barbin, „Water-repellent and biocide treatments: assessment of the potential combinations”, „Journal of Cultural Heritage”, 2008, 9, 394–400, doi:10.1016/J.CULHER.2008.02.002.
17. P. Munafò, G.B. Goffredo, E. Quagliarini, „TiO2-Based Nanocoatings for Preserving Architectural Stone Surfaces: An Overview”, „Construction and Building Materials” 2015, 84, 201–218, doi:10.1016/J.CONBUILDMAT.2015.02.083.
18. R. Carrillo-González, M.A. Martínez-Gómez, M. González-Chávez, C.A. del Mendoza, J.C. Hernández, „inhibition of microorganisms involved in deterioration of an archaeological site by silver nanoparticles produced by a green synthesis method”. „Science of The Total Environment”, 2016, 565, 872–881, doi:10.1016/J.SCITOTENV.2016.02.110.
19. PN-EN 15457:2022-08 „Farby i lakiery – Laboratoryjna metoda badania skuteczności w powłoce środków ochrony powłok przed grzybami”.
20. PN-EN 15458:2022-08 „Farby i lakiery – Laboratoryjna metoda badania skuteczności w powłoce środków ochrony powłok przed glonami”.
21. M. Komar, J. Szulc, I. Kata, K. Szafran, B. Gutarowska, „Development of a method for assessing the resistance of building coatings to phoatoautotrophic biofouling”, „Applied Sciences” 2023, 13, doi:10.3390/app13148009.
22. B.G. Shelton, K.H. Kirkland, W.D. Flanders, G.K. Morris, „Profiles of airborne fungi in buildings and outdoor environments in the united states”, „Applied and environmental microbiology”, 2002, 68, 1743–1753, doi:10.1128/AEM.68.4.1743-1753.2002.
23. Zgłoszenie patentowe: P.444942 „Sposób laboratoryjny oceny czasu trwałości zabezpieczenia przeciwgrzybowego i przeciwglonowego tynków budowlanych”, Politechnika Łódzka, 2023.